3.9 KiB
3.9 KiB
ChAdOx1 (AstraZeneca / Vaxzevria)
Mise à jour : 16 mai 2021
Données générales
| Type | Vecteur |
| Adjuvant | Particules affaiblies d’adénovirus de rhume |
| Dose administrée | 1 dose avec 5×10^10 particules virales, 1 dose avec 1x5×10^10 particules virales |
| Protection contre le COVID-19 | Dès deux semaines après première dose (Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials — The Lancet, 19 Février 2021) |
| Efficacitée estimée contre une infection par SARS-CoV-2 | 66% |
| Efficacité estimée contre une infection sévère par SARS-CoV-2 | 100% |
| Contre-indications | Grossesse, immunosuppression |
Phase 3 (Tests In Vivo)
| Nombre de participants | 40 051 |
| Âge | À partir de 18 ans |
| Placebo du groupe contrôle | Vaccin contre les méningocoques (MenACWY) |
| Date de première injection | 28 Août 2020 |
Phase 4 (Mise sur le marché et Pharmacovigilance)
Effets secondaires
| Effet | Cas concernés |
|---|
- Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK — The Lancet, 8 Décembre 2020
- Effets indésirables des vaccins contre le Covid-19 en suisse — SwissMedic, 7 Mai 2021
Effets secondaires graves
- 108 (0,9%) participants vaccinés et 127 (1,1%) participants du groupe témoin
- 7 décès, non liés à la vaccination. 2 dans le groupe vaccin, 5 dans le groupe témoin (dont un lié au covid)
Cas de thrombose
- Thromboembolism and the Oxford–AstraZeneca COVID-19 vaccine: side-effect or coincidence? — The Lancet, 30 Mars 2021
- Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination — NEJM, 9 Avril 2021
- Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination — NEJM, 9 Avril 2021
Royaume-Uni
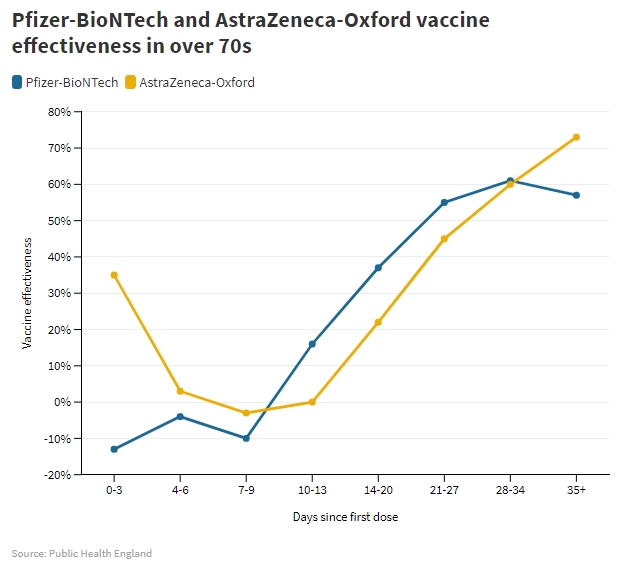
Early effectiveness of COVID-19 vaccination with BNT162b2 mRNA vaccine and ChAdOx1 adenovirus vector vaccine on symptomatic disease, hospitalisations and mortality in older adults in England — Public Health England
Autorisations
| Pays / Zone | Document(s) |
|---|---|
| Europe | EMA recommends first COVID-19 vaccine for authorisation in the EU |
| France | Vaccins autorisés — ANSM, 12 Mars 2021 |
| Suisse | Demande d’autorisation avec soumission des données en continu pour un vaccin contre le Covid-19: Swissmedic exige des données supplémentaires — SwissMedic, 3 Février 2021 |
32661-1_gr1.jpg)